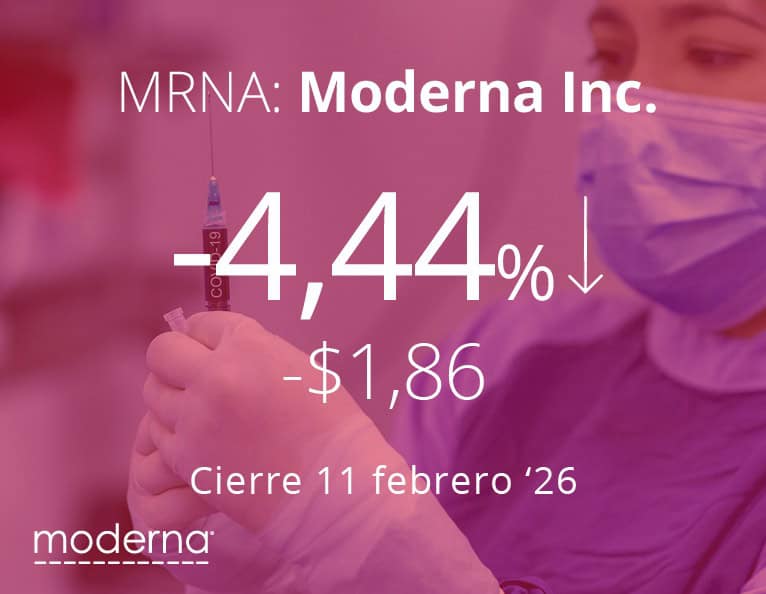
LA NOTICIA
La Administración de Alimentos y Medicamentos (FDA) se ha negado a iniciar la revisión de la solicitud de Moderna Inc. ($MRNA) para su vacuna experimental contra la gripe, según ha informado la empresa.
DAME CONTEXTO
Moderna afirmó que esta medida es incompatible con los comentarios previos de la agencia antes de que presentara la solicitud y comenzara los ensayos de fase III de la vacuna, denominada mRNA-1010. La empresa farmacéutica afirmó que ha solicitado una reunión con la FDA para «comprender el camino a seguir».
ENTONCES
Moderna señaló que la agencia no identificó ningún problema específico de seguridad o eficacia con la vacuna, sino que se opuso al diseño del estudio, a pesar de haberlo aprobado previamente. La empresa añadió que esta medida no afectará a sus previsiones financieras para 2026.
OTRA NOVEDAD
La vacuna de Moderna mostró datos positivos en la fase tres el año pasado, cumpliendo todos los objetivos del ensayo. En ese momento, la empresa afirmó que la vacuna contra la gripe independiente era clave para sus esfuerzos por avanzar en una vacuna combinada dirigida tanto a la gripe como a la COVID-19.
PARA NO PERDER DE VISTA
El anuncio se produce tras los cambios radicales en la política de inmunización de EEUU durante el último año bajo la dirección del secretario de Salud y Servicios Humanos, Robert F. Kennedy Jr., un destacado escéptico de las vacunas.
POR ÚLTIMO
Moderna señaló específicamente el martes al máximo responsable de la regulación de vacunas de la FDA, Vinay Prasad, que regresó a la agencia en agosto tras haber sido destituido. Prasad, que dirige el Centro de Evaluación e Investigación Biológica (CBER) de la agencia, se ha mostrado partidario de endurecer la normativa sobre vacunas y recientemente ha relacionado la muerte de niños con las vacunas contra la COVID-19.
![]()